Jenseits von immunbasierten Allergentests

Die meisten im Handel erhältlichen Testkits für Lebensmittelallergene beruhen auf der Anwendung immunologischer Methoden wie ELISA oder Lateral-Flow-Geräte (Streifentests). Für die Durchführung von ELISA ist geschultes Personal erforderlich, aber mit Hilfe von 48-Well- oder 96-Well-Mikrotiterplatten können zahlreiche Proben parallel analysiert werden. Im Allgemeinen kann die Analyse zwischen 30 Minuten und ein paar Stunden dauern. Derzeit ist der ELISA die am häufigsten angewandte Methode zum Nachweis und zur Quantifizierung von Lebensmittelallergenen. Doch obwohl viele Proben gleichzeitig analysiert werden können, können diese Proben nur auf einen Analyten getestet werden.
Zu beachtende Einschränkungen
Aufgrund der hohen Spezifität der Antikörper gegenüber nur einem bestimmten allergenen Protein und technologiebedingter Einschränkungen muss für jedes Allergen ein separates Kit verwendet werden. Außerdem kann der hohe Grad an Spezifität für ein Allergen zu falsch negativen Ergebnissen führen. Lebensmittelverarbeitungsschritte wie Wärmebehandlung, der Zusatz von sauren Verbindungen oder Fermentation können die Struktur des Zielproteins verändern. Diese modifizierten Allergene können ihre immunologischen Eigenschaften verlieren und der Antikörper-Zielprotein-Komplex kann nicht mehr gebildet werden. Dies führt zu falsch negativen Ergebnissen oder reduzierten Quantifizierungen. Streifentests sind kostengünstig, sehr einfach zu handhaben, erfordern keine Laborausrüstung und liefern Ergebnisse in der Regel in wenigen Minuten. Die meisten Streifentests sind jedoch nur qualitativ und stützen sich auf Antikörper als Erkennungselemente. Daher leiden sie unter denselben Problemen wie ELISA-Tests bei stark verarbeiteten Lebensmitteln. In den letzten Jahren wurden alternative Analysemethoden entwickelt, die zumindest einige der Einschränkungen der immunbasierten Testsysteme überwinden.
Nachweis von Allergenen mit DNA
Die PCR (Polymerase-Kettenreaktion) ist eine relativ schnelle und kostengünstige Methode zur Identifizierung von DNA. Diese Technologie wurde in den 1980er Jahren entwickelt und hat sich seither kontinuierlich verbessert. Die PCR wird seit vielen Jahren in der medizinischen Diagnostik, der Forensik, der Umweltüberwachung und der Quantifizierung von genetisch veränderten Organismen in Lebens- und Futtermitteln eingesetzt. In den frühen 2000er Jahren wurde die PCR zum ersten Mal zur Identifizierung der DNA gängiger Lebensmittelallergene wie Haselnuss und Erdnuss eingesetzt. Bisher wurden PCR-Tests für die meisten der "Big Eight" in den USA und die 14 EU-Lebensmittelallergene veröffentlicht. Bei der PCR werden kleine Fragmente einer Ziel-DNA amplifiziert, bis eine ausreichende Anzahl von Kopien für die Visualisierung oder Quantifizierung erreicht ist. Durch die Multiplikation des analytischen Ziels mit einem Faktor von 107 bis 109 können die wenigen erhaltenen Moleküle der Allergen-DNA für den erfolgreichen Nachweis allergener Zutaten gerade noch ausreichen. Ursprünglich als qualitative Methode entwickelt, wurde die PCR später durch den Einsatz verschiedener fluoreszierender Farbstoffe oder Sonden zu einem Werkzeug für die quantitative Analyse modifiziert. Die Tatsache, dass die PCR das extrem stabile DNA-Molekül nachweist, könnte bei der Analyse von stark verarbeiteten Lebensmitteln von Vorteil sein. Die DNA neigt dazu, selbst unter extremen Bedingungen unbeeinflusst zu bleiben und kann daher auch dann noch nachgewiesen werden, wenn die meisten Proteine bereits abgebaut oder auf irgendeine Weise verändert wurden. Außerdem kann die PCR für Allergene wie Sellerie verwendet werden, die von Antikörpern nicht erkannt werden können. Sellerie ist in der EU kennzeichnungspflichtig, aber bisher sind alle Versuche, zuverlässige Antikörper herzustellen, an der engen Verwandtschaft zwischen Sellerie und anderen Pflanzen wie Petersilie, Karotte, Koriander oder Fenchel gescheitert. In den letzten zehn Jahren wurden neuere DNA-Nachweisverfahren entwickelt. Alle diese so genannten isothermen Amplifikationsmethoden sind in gewisser Weise mit der herkömmlichen PCR verwandt, können aber fast ohne jegliche Instrumente durchgeführt werden. Ein einfacher Heizblock wird zur Amplifikation der Ziel-DNA verwendet und der anschließende visuelle Nachweis erfolgt über Fluoreszenzfarbstoffe. Die isothermale Amplifikation ist in der Regel schneller als die PCR und weniger anfällig für mitisolierte Verunreinigungen und in vielen Fällen sogar empfindlicher.
Veröffentlicht am:
Lebensmittel-Allergene
Dieser Artikel wurde in Spot On #2 veröffentlicht.
Sind Sie neugierig, was Spot On zu bieten hat?
Magazin aufrufen
Warum DNA-Techniken scheitern können
Obwohl der Nachweis der DNA von allergenen Lebensmitteln einige Vorteile gegenüber immunbasierten Methoden hat, hat dieser Ansatz einige gravierende Nachteile. Da DNA der Analyt der Wahl für die PCR ist, ist es schwierig/unmöglich, zwischen Ei oder Milch und der entsprechenden Gewebe-DNA von Hühnern oder Kühen zu unterscheiden, da sie identische DNA enthalten. Einige Proben wie Eiklar oder Milch enthalten nur geringe Mengen an DNA, aber viele allergene Proteine. Daher ist diese Methode für die Analyse solcher Proben nicht geeignet.
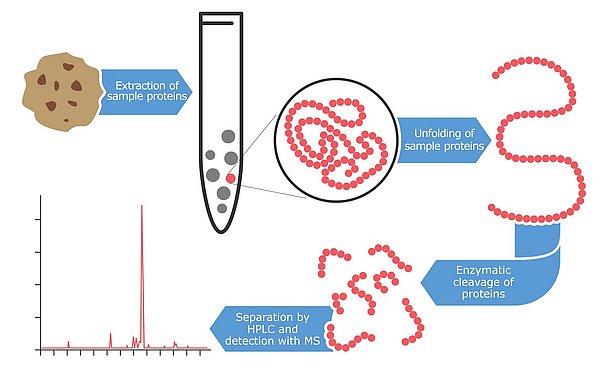
Massenspektrometrie: eine Spitzentechnologie
Eine noch neuere Technologie zum Nachweis und zur Quantifizierung von Allergenen ist die Massenspektrometrie, eine High-Tech-Methode, die Proteine und Peptide mit einer sehr hohen Genauigkeit identifiziert. Die ersten Versuche, diese Technologie zum Nachweis von Allergenen einzusetzen, begannen in den späten 1990er Jahren, aber die meisten Ergebnisse wurden erst in den letzten Jahren veröffentlicht. Der Hauptvorteil der Verwendung dieser Technologie für Allergentests ist das hohe Maß an Vertrauen und Zuverlässigkeit. Die Geräte sind in der Lage, mehrere Peptide pro Protein nachzuweisen. Im Idealfall werden zwei bis drei Fragmentpeptide pro Allergen analysiert. Der Vorteil dieses Ansatzes besteht darin, dass die Wahrscheinlichkeit, mindestens ein intaktes Fragment zu finden, recht hoch ist, selbst wenn die Proteine aufgrund der rauen Bedingungen bei der Lebensmittelverarbeitung teilweise abgebaut oder modifiziert wurden. Diese Markerpeptide werden aus Datenbanken oder aus der Literatur ausgewählt und müssen hochspezifisch für die zu quantifizierenden Allergene sein. Außerdem werden sie so ausgewählt, dass sie gegen Veränderungen bei der Lebensmittelverarbeitung resistent sind. Diese Multi-Peptid-Erkennungsstrategie des Allergens ist bei immunbasierten Assays nicht möglich. Antikörper binden normalerweise nur an ein bestimmtes (immunogenes) Fragment des Allergens. Wenn dieses kleine Fragment verändert wird, kann die Erkennung des Ziels beeinträchtigt werden. Darüber hinaus ist die Massenspektrometrie in der Lage, mehrere Allergene parallel zu messen. Diese Multi-Analytik-Methoden sind in den letzten Jahren besonders beliebt geworden. Mit dieser innovativen Strategie kann eine einzige Extraktion einer Probe in einem einzigen Analyselauf auf zahlreiche Allergene untersucht werden. Das Extraktionsverfahren für die Massenspektrometrie-Analyse ist aufwändiger als bei anderen Ansätzen. Zunächst wird die Probe mit einem Extraktionspuffer vermischt, der häufig Dithiothreitol oder Harnstoff enthält, um eine reduzierende Umgebung zu schaffen, die Disulfidbindungen von Proteinen aufbricht. Der verbleibende Probenrückstand wird dann durch Zentrifugation entfernt und die linearisierten Proteine werden mit Verdauungsenzymen gespalten. Es dauert einige Stunden oder eine Nacht, um die allergenen Proteine mit diesen Enzymen in kleine Peptidfragmente zu zerschneiden. Obwohl die vorbereitenden Schritte zeitaufwendig sind, kann die resultierende Peptidlösung anschließend mit dem Massenspektrometer parallel auf mehrere Allergene analysiert werden. Die derzeitigen Multimethoden können bis zu sieben Allergene parallel quantifizieren, aber es ist zu erwarten, dass sich diese Zahl in den nächsten Jahren drastisch erhöhen wird. Mykotoxin-Multi-Analytik-Methoden begannen vor etwa 10 Jahren mit einigen wenigen Analyten. Heute sind die fortschrittlichsten Assay-Designs in der Lage, mehr als 400 Toxine parallel zu analysieren.
Die beste Methode?
Die Massenspektrometrie kann wahrscheinlich als die Allergen-Testmethode mit dem größten Potenzial für zukünftige Verbesserungen angesehen werden, da sie besonders zuverlässig und empfindlich ist und die Möglichkeit bietet, Multi-Allergen-Analysen durchzuführen.
Allerdings gibt es keinen Ansatz ohne Nachteile. Die Massenspektrometrie erfordert hochqualifiziertes Personal und die anfänglichen Investitionskosten sind aufgrund der teuren Instrumente hoch. Außerdem dauert es immer viel länger, bis ein Ergebnis vorliegt, als bei Immuno-Methoden.
Keine Einheitsgröße für alle
Die perfekte Methode, einen Goldstandard für die Quantifizierung von Allergenen, gibt es nicht. ELISA und LFDs sind die Methode der Wahl für die meisten industriellen Anwendungen. Die Ergebnisse sind relativ schnell zu erhalten, die Kosten sind moderat bis niedrig und das Personal kann leicht für die Anwendung dieser Tests geschult werden. Bei einigen Problemen wie stark verarbeitetem Testmaterial oder spezifischen Analyten kann die PCR zu besseren Ergebnissen führen. Die Massenspektrometrie befindet sich am oberen Ende der verfügbaren Technologien, steckt aber für Allergentests noch in den Kinderschuhen. Allerdings ist sie in den letzten Jahren zur Methode der Wahl für viele andere analytische Herausforderungen geworden. Es ist zu erwarten, dass diese Technologie in naher Zukunft einen Aufschwung auf dem Gebiet der Allergenanalyse erleben wird.