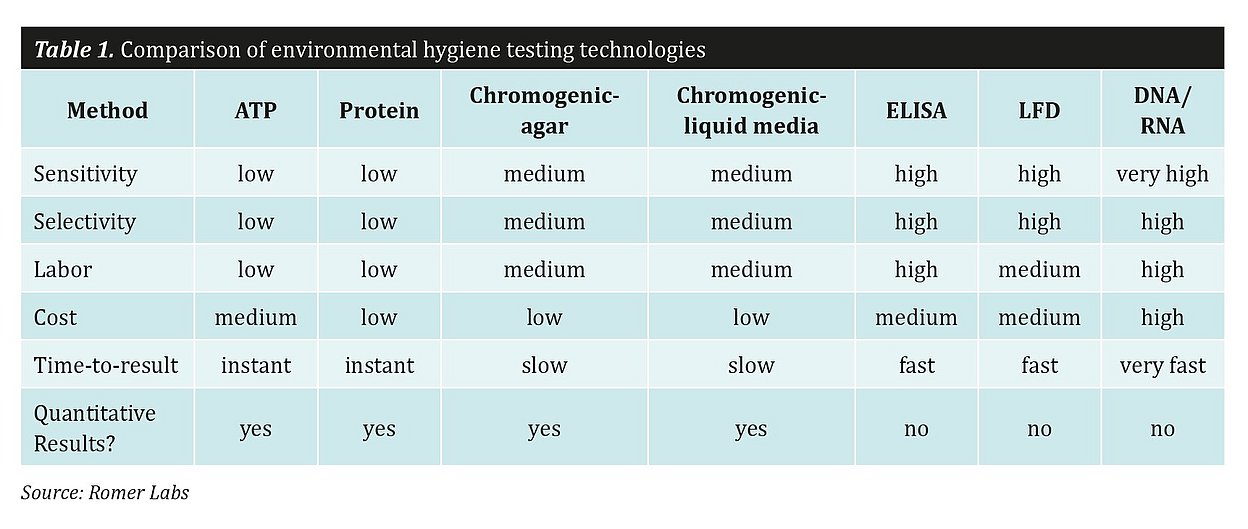
Schnelle Technologien für Umwelthygienetests: Ein näherer Blick

Die üblicherweise verwendeten Umwelttesttechnologien lassen sich in zwei allgemeine Ansätze unterteilen: Tests auf Rückstände und Tests auf Mikroorganismen. Im Folgenden untersuchen wir die verschiedenen Technologien innerhalb jedes Ansatzes, ihre Funktionsweise sowie ihre Anwendbarkeit und Vorteile.
Rückstandstests
ATP-Methoden
Adenosintriphosphat (ATP) ist ein Nukleotid, das in Zellen als Coenzym für die Bereitstellung von Energie verwendet wird. Es kann als molekulare "Währungseinheit" für die Energieübertragung in allen lebenden Zellen betrachtet werden. Energie wird für alle zellulären Aktivitäten benötigt, einschließlich der Synthese von Proteinen und Membranen, der Zellbewegung und der Zellteilung. Energie wird übertragen, wenn ATP in Adenosindiphosphat und Adenosinmonophosphat zerfällt. Durch die Hydrolyse der kovalenten Verbindungen der Phosphate wird Energie freigesetzt, die für Reaktionen genutzt wird.
Kommerzielle ATP-Testsysteme machen sich die in der Natur weit verbreitete Luciferin/Luciferase-Reaktion zunutze, um mit der von ATP bereitgestellten Energie sichtbares Licht zu erzeugen. Je mehr Licht emittiert wird, desto mehr ATP ist vorhanden, was auf mehr Lebensmittelrückstände oder mehr Mikroorganismen hinweist. Es gibt jedoch einen wichtigen Vorbehalt: Da diese Systeme häufig zur Validierung der Reinigungsleistung eingesetzt werden, sind häufig auch Desinfektionsmittel an der Reaktion beteiligt. Diese Desinfektionsmittel können die Zellwände der Mikroorganismen angreifen, erhalten aber ihr ATP. Das bedeutet, dass es möglicherweise keine echte Korrelation zwischen den auf der Oberfläche vorhandenen lebenden Organismen und den Ergebnissen der ATP-Messung gibt.
ATP-Methoden bergen einen weiteren potenziellen Nachteil: Sie sind je nach dem nachzuweisenden Lebensmittelrückstand unterschiedlich gut geeignet. ATP-Tests eignen sich beispielsweise nicht für die Untersuchung von Weizenmehl, da es eine stark verarbeitete Matrix ist, die nur wenig ATP in ihren Rückständen hinterlässt. Rückstände von Fleischprodukten enthalten jedoch hohe Mengen an ATP.
Methoden zum Nachweis von Gesamtprotein
Eine weitere Methode zum Testen von Rückständen ist der Gesamtproteinnachweis, bei dem nicht auf Mikroorganismen, sondern auf Aminosäuren, Peptide und Proteine getestet wird. Diese Tests sind sehr schnell und liefern Ergebnisse innerhalb einer Minute. Der Nachweis ist nicht empfindlich genug, um Proteine von einzelligen Mikroorganismen nachzuweisen. Daher bedeutet ein negatives Ergebnis bei dieser Art von Test nicht, dass der Mikroorganismus nicht vorhanden ist. Außerdem gibt es keine Möglichkeit, mit dieser Methode spezifische Krankheitserreger nachzuweisen. Dennoch sind Testkits zum Nachweis von Proteinen nützlich, da sie schnell und kostengünstig Hinweise auf die Effizienz der Reinigung liefern können.
Tests auf Mikroorganismen
Chromogene kulturelle Methoden
Dies sind die traditionellen Methoden zur Überwachung der Hygiene in der Verarbeitungsumgebung. Kulturelle Methoden werden in ISO 18593, "Mikrobiologie der Lebensmittelkette - Horizontale Methoden für Oberflächenproben" behandelt. Zum Nachweis bestimmter Organismen können nicht-selektive und selektive Medien verwendet werden.
Methoden auf Basis von chromogenem Agar
Im Allgemeinen gibt es zwei Möglichkeiten, agarbasierte Methoden durchzuführen: entweder direkt oder indirekt über einen Verdünnungsschritt. Ein Vorteil beider Methoden ist, dass sie quantitative Ergebnisse liefern.
Bei direkten Methoden wird der Agar von Platten oder Dip-Slides direkt auf die zu beprobende Oberfläche gedrückt. Kontaktplatten haben die Form von klassischen Petrischalen und haben in der Regel eine Oberfläche von 25 cm². Dip-Slides sind doppelseitige Agar-Paddles, die durch ein Kunststoffrohr geschützt sind und eine Agar-Oberfläche von 7-10 cm² auf jeder Seite des Paddles haben, was 14-20 cm² entspricht. Diese Systeme erfordern keine zusätzliche Ausrüstung und das Probenahmeverfahren ist sehr schnell. Allerdings ist die Probenahmefläche bei dieser Methode begrenzt.
Tupfer, Tücher und Schwämme sind Hilfsmittel für die indirekte Probenahme. Nachdem sie über die zu testende Oberfläche getupft wurden, werden sie in einer Pufferlösung verdünnt, die dann in herkömmliche Petrischalen pipettiert und ausgestrichen wird. Die getestete Oberfläche kann viel größer sein und auch enge Räume und Lücken können mit einer indirekten Methode getestet werden. Indirekte Methoden haben jedoch einen Nachteil: Es gibt mehr Arbeitsschritte und es werden zusätzliche Materialien benötigt. Für den Erregernachweis empfiehlt die ISO-Norm eine Fläche zwischen 1000 cm² und 3000 cm²; eine so große Fläche kann nur mit Schwämmen oder Abstrichtüchern bearbeitet werden.
Nachweismethoden auf Basis chromogener Flüssigmedien
Diese kulturelle Methode wird nur zum Nachweis, nicht aber zur Zählung bestimmter Organismen oder Organismengruppen verwendet, da sie keine quantitativen Ergebnisse liefert. Bei den auf Flüssigmedien basierenden Methoden werden Abstrichtupfer zur Probenentnahme verwendet und dann in Röhrchen mit Selektivmedien gegeben. Im Durchschnitt dauert die Inkubation mindestens 48 Stunden für vermutlich negative Ergebnisse. Positive Proben werden durch eine Farbveränderung oder Fluoreszenz bei einer bestimmten Wellenlänge der angereicherten Probe identifiziert. Diese Tests sind im Allgemeinen einfach zu handhaben und erschwinglich.
Der Nachteil der auf Flüssigmedien basierenden Systeme ist ihre geringe Empfindlichkeit, die auf hochselektive Medien zurückzuführen ist, die das Wachstum anderer Bakterien absichtlich unterdrücken. Dies birgt ein gewisses Risiko: Die Bakterien in der Verarbeitungsumgebung sind bereits gestresst und können absterben, wenn die Anreicherungsmedien zu selektiv sind. Ist die Selektivität hingegen zu gering, kann es schwierig sein, spezifische Mikroorganismen allein mit selektiven Flüssigmedien nachzuweisen. Die Interpretation der Ergebnisse kann schwierig und subjektiv werden, da die Farbveränderung oder die Fluoreszenz nicht immer stark genug ist, um ein definitives Ergebnis anzuzeigen. Der Hauptvorteil der auf Flüssigmedien basierenden Methoden ist, dass sie einfach zu handhaben und erschwinglich sind.
DNA-basierte Methoden
Es gibt drei verschiedene DNA-basierte Methoden: die isotherme Amplifikation von DNA, die Echtzeit-PCR und die traditionelle PCR. Die Echtzeit-PCR ist eine etablierte Methode für den Nachweis von DNA oder RNA, während die isothermische Amplifikation eine neuere Technologie ist. Die isothermische Amplifikation hat gegenüber der Echtzeit-PCR klare Vorteile: So wird für die isothermische Amplifikation kein Thermocycler benötigt, da die Reaktion bei einer konstanten Temperatur abläuft. Die kosteneffektivste, aber auch arbeitsintensivste DNA-basierte Methode ist die traditionelle PCR, da ein Hybridisierungsschritt oder die Verwendung eines eher unspezifischen Farbstoffs nach der Amplifikation erforderlich ist, um die amplifizierte DNA oder RNA nachzuweisen. Bei allen Methoden werden bestimmte Teile der DNA oder RNA durch spezifische Primer erkannt und dann durch das Enzym Polymerase vervielfältigt. Die Empfindlichkeit dieser Methoden ist bemerkenswert hoch, und die Zielregionen in der DNA oder RNA sind gut bekannt. Die größte Einschränkung dieses Systems ist, dass es sich um ein enzymbasiertes System handelt. Enzyme benötigen bestimmte Pufferlösungen, um richtig zu funktionieren. Inhaltsstoffe in Desinfektionsmitteln können die Enzymaktivität beeinflussen, was zu falsch negativen Ergebnissen führen kann. Die Technologie erfordert außerdem mehrere Schritte der Mikropipettierung, was eine ernsthafte Fehlerquelle darstellen kann. Der größte Vorteil der DNA-basierten Methoden ist, dass dank der hohen Empfindlichkeit der Methode nicht-selektive Medien für den Anreicherungsschritt verwendet werden können. Nicht-selektive Medien sind erschwinglich, von verschiedenen Anbietern erhältlich und erfordern die niedrigste Biosicherheitsstufe (Stufe 1). Es ist auch möglich, geringe Mengen von Krankheitserregern auf Umweltoberflächen ohne Anreicherung mit DNA-basierten Methoden nachzuweisen, aber die Sensitivität ist im Vergleich zu der von Anreicherungsmethoden gering. Schließlich könnten falsch positive Ergebnisse durch DNA-Fragmente von bereits abgetöteten Krankheitserregern ein großes Problem darstellen.
Immunologische Methoden
Immunoassays sind Systeme, die Antikörper verwenden, um die Anwesenheit von Mikroorganismen in Lösungen nachzuweisen. Diese Antikörper können an Antigene wie Lipopolysaccharide auf der Zelloberfläche oder Geißeln bestimmter Mikroorganismen binden. Nach einem einfachen oder mehrfachen Anreicherungsverfahren, das selektive Medien einschließt, werden Krankheitserreger wie Listeria-Zellen mit spezifischen, auf Antikörpern basierenden Testsystemen nachgewiesen. ELISA-Tests (enzyme-linked immunosorbent assay) waren die ersten, die eine immunologische Technologie zum Nachweis spezifischer Mikroorganismen einsetzten. ELISA ermöglicht die Quantifizierung des nachgewiesenen Analyten, aber die Notwendigkeit eines Anreicherungsschritts schließt eine Berechnung der Ausgangskonzentration aus. Nur geschultes Personal kann die zahlreichen Transfer- und Waschschritte durchführen, die ELISAs erfordern. Die Entwicklung von Lateral-Flow-Geräten, die auch als Streifentests bekannt sind, löste dieses Problem, wodurch das immunologische Nachweisverfahren viel einfacher und schneller wurde und der Arbeitsaufwand von ELISA-Tests entfiel. LFDs mit selektiven Antikörpern, die in Kombination mit hochleistungsfähigen Anreicherungsmedien verwendet werden, ermöglichen schnelle und genaue Ergebnisse, ohne dass teure Geräte oder Kosten für Schulungen erforderlich sind.
Fazit
Die Wahl der richtigen Hygienetesttechnologie ist nicht immer eine leichte Aufgabe. Es gibt mehrere praktische Überlegungen, die die Entscheidung beeinflussen: Wie viele Probenahmestellen müssen getestet werden und wie wichtig ist der Testdurchsatz? Wie können die Tester die Zeit bis zum Vorliegen eines Ergebnisses optimieren, wenn man bedenkt, dass Tests auf einige pathogene Bakterien nicht täglich durchgeführt werden und eher eine Überwachungsaufgabe als ein Qualitätskontrollverfahren darstellen? Werden quantitative Ergebnisse benötigt, oder reicht ein Anwesenheits-/Abwesenheitstest aus? Da es immer noch nicht möglich ist, unmittelbar nach der Reinigung Keimzahlen zu erhalten, verlassen sich die Produzenten möglicherweise auf ATP- oder proteinbasierte Testsysteme, die als vager Indikator dafür dienen können, ob es sicher ist, mit der Produktion zu beginnen, d.h. ob ATP oder Protein vorhanden ist. Auch die nationalen Vorschriften können diese Entscheidung beeinflussen. Anreicherungsbasierte DNA- oder immunologische Methoden sind anderen Methoden in Bezug auf Empfindlichkeit und Selektivität überlegen und sollten die Systeme der Wahl für den Erregernachweis sein. Für den Nachweis und die Zählung von Indikatororganismen oder die Überwachung der allgemeinen Hygiene können günstigere Systeme wie Dip-Slides oder ATP-Systeme verwendet werden.
Veröffentlicht am:
Mikrobiologie
Dieser Artikel wurde in Spot On #8 veröffentlicht.
Sind Sie neugierig, was Spot On zu bieten hat?
Magazin aufrufen