Kleiner ist besser: Verbesserte Mykotoxin-Analyseergebnisse durch Reduzierung der Partikelgröße

Neueste Forschungsergebnisse zeigen, dass die Partikelgröße in einer Probe einen erheblichen Einfluss auf die Genauigkeit von Mykotoxin-Analysemethoden hat. Die Mykotoxin-Experten Henriette Hobbs und Nora Kogelnik gehen auf das Problem ein und geben einige Empfehlungen, wie Sie Ihre Mykotoxin-Tests genau und zuverlässig durchführen können.
Veröffentlicht am:
Mykotoxin
Dieser Artikel wurde in Spot On #13 veröffentlicht.
Sind Sie neugierig, was Spot On zu bieten hat?
Magazin aufrufen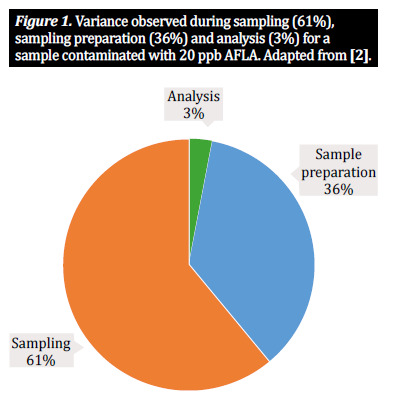
Vielleicht eine Schlagzeile? (mgr)
In der Mykotoxin-Analytik arbeiten wir bei landwirtschaftlichen Rohstoffen wie Mais, Weizen und Gerste in der Regel mit drei Hauptverfahrensschritten: Probenahme, Probenvorbereitung und Analyse. Um die Mykotoxinkonzentration in einer Partie zu bestimmen, müssen wir einen kleineren, aber immer noch repräsentativen Teil der Partie analysieren. Das bedeutet, dass zuverlässige Ergebnisse ohne einen angemessenen Probenahmeplan nicht möglich sind, der die Entnahme von Einzelproben der Partie und deren Zusammenfassung zu einer Teilprobe (auch als Sammelprobe bezeichnet) umfasst. Auf diese Weise wird sichergestellt, dass die zu untersuchende Probe wirklich repräsentativ für die gesamte Partie ist. Von hier aus wenden wir uns der Probenvorbereitung zu. Bei Produkten auf Getreidebasis besteht die Probenvorbereitung aus zwei wichtigen Schritten: dem Mahlen der Probe und der Teilprobe: 1) Eine Mühle oder ein anderes Gerät wird verwendet, um das Getreide in der Gesamtprobe zu mahlen, um die Partikelgröße zu reduzieren und die Einheitlichkeit zu gewährleisten. 2) Aus dieser Probe erhalten wir eine für die gesamte Partie repräsentative Teilprobe, die wir dann testen. Diese Testprobe wird anschließend für die Extraktion nach einem festgelegten Protokoll vorbereitet [10]. Die Probenahme und die Probenvorbereitung sind jedoch komplexe Prozesse, die mit potenziellen Fallstricken behaftet sind. Jeder Schritt innerhalb des Probenvorbereitungsprozesses führt zu einer gewissen Variabilität, die zur Gesamtvariabilität eines einzelnen Analyseergebnisses beiträgt [2, 5]. Zahlreiche Studien haben gezeigt, dass zwei Drittel der beobachteten Variabilität auf die Methode der Probenahme zurückzuführen sind, ein Drittel auf die Art der Probenvorbereitung. Ein weitaus geringerer Prozentsatz der Variabilität bezieht sich auf die angewandte Analysemethode (Abbildung 1). Folglich hängen genaue Ergebnisse davon ab, inwieweit wir diese drei Faktoren berücksichtigen. Während zahlreiche Studien die Bedeutung von Probenahmeverfahren und analytischen Lösungsmitteln für die Wirkung des Mykotoxinnachweises erörtern (siehe [1, 2, 4] für prominente Beispiele), wird in diesem Artikel die Bedeutung der Probenvorbereitung, d.h. der Zerkleinerung und des Probenumfangs, betrachtet und in einer Zusammenfassung der jüngsten Forschung zu diesem Thema die Wirkung der Probenvorbereitung auf die genaue Mykotoxinanalyse und die Probenvarianz diskutiert [10].
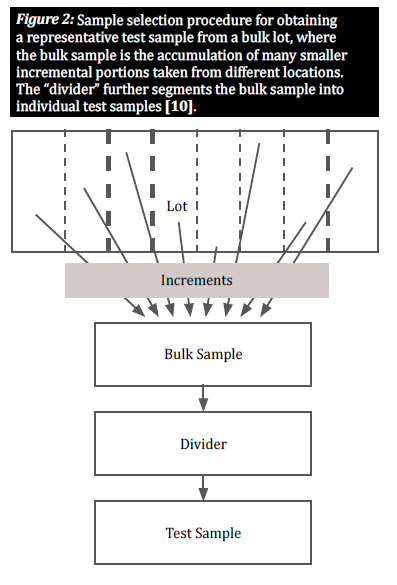
Wählen Sie eine repräsentative Probe
Wenn eine Ware auf natürliche Weise mit Mykotoxinen kontaminiert ist, sind die kontaminierten Kerne in der Regel ungleichmäßig über eine bestimmte Partie verteilt; diese Gruppierungen von kontaminierten Kernen werden als "Hot Spots" bezeichnet. Um ein genaues Bild vom Grad der Kontamination einer Partie zu erhalten, muss ein Probenahmeplan die zufällige Verteilung solcher Hot Spots berücksichtigen. Dies geschieht durch die Entnahme einer großen Anzahl kleiner Einzelproben an verschiedenen, über die gesamte Partie verteilten Stellen, um eine repräsentative Probe zu erhalten (Abbildung 2) [8]. Die Auswahl von Einzelproben aus einer großen Partie ist entscheidend, um allen Körnern die gleiche Chance zu geben, ausgewählt zu werden, und so Verzerrungen zu vermeiden [10].
Mahlen, um eine einheitliche Partikelgröße zu gewährleisten
Die Schimmelpilze, die Mykotoxine produzieren, verfügen über mehrere verschiedene Kontaminationswege; daher können Mykotoxine sowohl im Inneren der Körner als auch auf der Oberfläche gefunden werden. Der Infektionsweg hängt von dem Mykotoxin und dem betreffenden Getreide ab. Es ist bekannt, dass bestimmte mykotoxinproduzierende Pilze, wie z.B. Fusarium, im Inneren des Korns oder Kerns vorkommen, während andere, wie z.B. Aspergillus, auf der Oberfläche zu finden sind. Das gleichmäßige Mahlen einer Probe löst dieses Problem, indem es kontaminierte Körner aufbricht und eine gleichmäßige Verteilung der Partikel ermöglicht. Dies verbessert letztendlich die Erkennung kontaminierter Partikel [3].
Homogenisieren Sie die potenzielle Mykotoxinverteilung, indem Sie das Getreide durch ein Sieb streichen und mischen.
Nach der Auswahl der Probe, die repräsentativ für die Partie sein soll, und dem Mahlen, um eine einheitliche Partikelgröße zu gewährleisten, muss die Probe durch gründliches Mischen homogenisiert werden; dies trägt ebenfalls dazu bei, dass sie repräsentativ für die Gesamtprobe ist [3]. Die Körner entmischen sich je nach Größe, was die Repräsentativität der Probe verringert und zu einem ungenauen Analyseergebnis führt. Aus diesem Grund vergewissern wir uns vor dem Mischen, dass die Gleichmäßigkeit des Mahlguts ausreichend ist, indem wir die gemahlene Probe durch ein Netz oder ein Sieb geben. Das Ziel ist nicht, größere Partikel herauszufiltern, da diese ebenfalls Mykotoxine enthalten können; im Gegenteil, diese größeren Partikel müssen in der Probe enthalten sein. Vielmehr stellen wir die Gleichmäßigkeit des Mahlguts sicher, indem wir prüfen, ob ein bestimmter Prozentsatz der Partikel durchgelassen wird. Das USDA-FGIS hat zum Beispiel Spezifikationen für die Probengröße, das Mahlen der Proben und die Unterprobenahme für Aflatoxin, Deoxynivalenol, Fumonisin, Ochratoxin und Zearalenon festgelegt [9]. Das USDA-FGIS empfiehlt, eine Probe so zu mahlen, dass 60-75% der Partikel durch ein Sieb Nr. 20 fallen und 50 g Probe (einschließlich der Partikel, die nicht durch das Sieb fallen) für die Extraktion des Mykotoxins zu verwenden.
Halten Sie Ihre Korngröße klein, Ihre Probengröße groß und Ihre Mykotoxin-Ergebnisse genau
Da wir in diesem Artikel die Begriffe "Genauigkeit" und "Präzision" verwenden, ist eine kurze Definition dieser Begriffe angebracht: Genauigkeit und Präzision bezeichnen Unsicherheiten im Zusammenhang mit der Analyse, die durch die ursprüngliche Probenvorbereitungsmethode oder den Plan entstehen können. Die Genauigkeit ist definiert als die Nähe eines gemessenen Wertes zum wahren Wert, während die Präzision definiert ist als die Nähe der gemessenen Werte zueinander. Das ultimative Ziel sollte sein, ein Verfahren zu implementieren, das sowohl eine hohe Genauigkeit als auch eine hohe Präzision gewährleistet [10]. Studien zeigen, dass die Präzision eines Mykotoxin-Nachweisverfahrens und damit die Varianz der Ergebnisse stark von der Größe der Partikel in der Probe abhängt. Zur Veranschaulichung der Messvariabilität in Verbindung mit der Größe der Partikel in der Probe und der Größe der zu untersuchenden Probe verweisen wir auf mehrere Studien, die dies untersucht haben (Abbildung 3 und Abbildung 4). In der ersten Studie, die von Whitaker et al. durchgeführt wurde (siehe Abbildung 3), wurden Maisproben, die auf natürliche Weise mit Aflatoxin kontaminiert waren, charakterisiert. Die Proben mit unterschiedlich großen Körnern wurden anschließend durch ein Sieb Nr. 20 gestrichen: 1) grob gemahlen (60% der Partikel wurden durchgelassen), 2) fein gemahlen (99% der Partikel wurden durchgelassen) und 3) pulverisiert (mit einer Hammermühle). Acht Proben aus jedem Mahlintervall wurden dann mit einer modifizierten HPLC-Referenzmethode analysiert, um die Varianz zwischen den Proben innerhalb eines einzelnen Mahlzustands nachzuweisen [9].
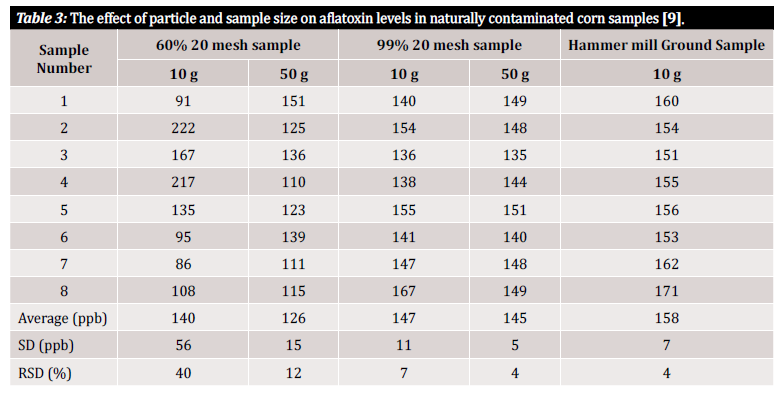
Wie Sie in Tabelle 3 sehen können, variieren die Analyseergebnisse sowohl in Abhängigkeit von der Probengröße als auch von der Größe des Mahlguts. Doch wie können wir diese Schwankungen so quantifizieren, dass sie für uns nützlich sind? Die relative Standardabweichung (RSD) oder der Variationskoeffizient (CV) werden häufig verwendet, um festzustellen, wie unterschiedlich die Ergebnisse in einem bestimmten Datensatz sind. Die RSD wird oft als Prozentsatz angegeben und ist durch das Verhältnis der Standardabweichung zum Mittelwert definiert. Je niedriger die Standardabweichung ist, desto geringer ist die Abweichung innerhalb des Datensatzes und desto zuverlässiger ist das Ergebnis. Bei den in Tabelle 3 dargestellten Daten aus der Studie wurde eine signifikante Variabilität zwischen Proben von 10 g, die aus verschiedenen Partikelgrößen bestanden, beobachtet. Die 10 g grob gemahlenen Proben weisen mit 40% die höchste RSD auf, verglichen mit der feiner gemahlenen Probe (99% 20-mesh Probe), mit einer berechneten RSD von 7%. Die niedrigste RSD, 4%, wurde mit pulverisierten Proben aus der Hammermühle erreicht. Obwohl eine Hammermühle für den durchschnittlichen Tester in der Regel nicht finanzierbar ist, zeigt die Studie von Whitaker et al., dass die beste Methode zur Vermeidung von Abweichungen aufgrund der Probenvorbereitung darin besteht, die Proben fein zu mahlen und ein Sieb zu verwenden, um die Einheitlichkeit der Partikelgröße zu gewährleisten [9].
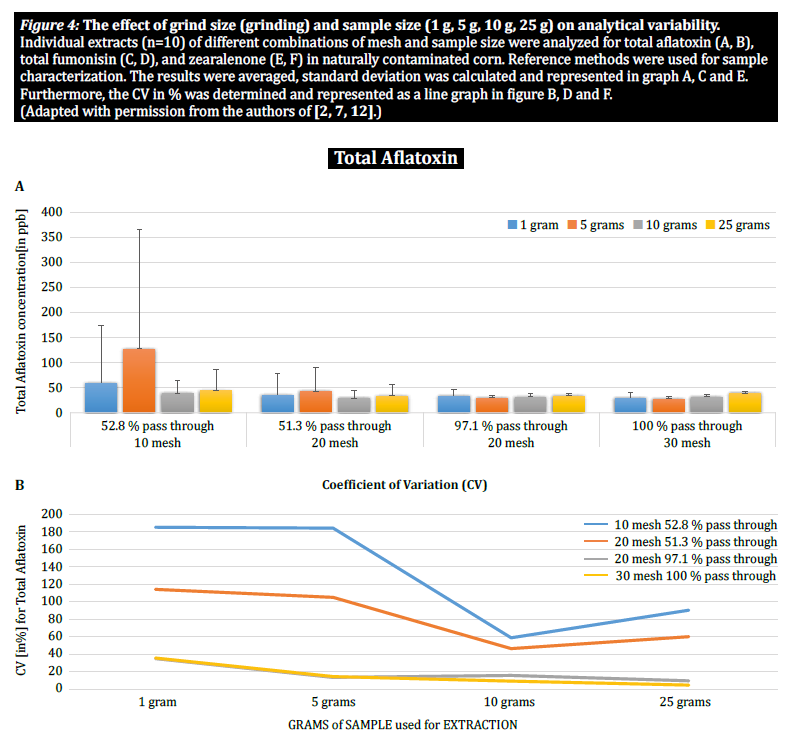
Um den Einfluss der Partikelgröße (Mahlen) und der Probengröße auf die analytische Variabilität zwischen verschiedenen Mykotoxinen weiter zu demonstrieren, führten Brunkhorst et al. eine Analyse von Maisproben durch, die auf natürliche Weise entweder mit Gesamt-Aflatoxin (Summe von B1, B2, G1 und G2), Gesamt-Fumonisin (Summe von B1, B2 und B3) oder Zearelenon kontaminiert waren (Abbildung 4). Für diese Studie wurden 10 Maisproben für jedes Mykotoxin auf verschiedene Partikelgrößen gemahlen, so dass sie entweder durch ein Nr. 10-Sieb, ein Nr. 20-Sieb oder durch ein Sieb passen. 10-Sieb, ein 20er-Sieb oder ein 30er-Sieb. 30-Sieb. Die Varianz der verschiedenen Probengrößen (1 g, 5 g, 10 g und 25 g) für die Extraktion wurde ebenfalls weiter untersucht. Die Aflatoxinproben wurden mit Acetonitril/Wasser (84/16) extrahiert und mit einer AOAC-Methode und einer KOBRA-Zelle für die Bromierung nach der Säule analysiert. Die Fumonisinproben wurden mit Methanol/Wasser (3/1) extrahiert und ebenfalls nach der AOAC-Methode analysiert. Die Zearealenon-Proben wurden ebenfalls mit Acetonitril/Wasser extrahiert und mittels LC-MS/MS analysiert. Hinweis: Die in den einzelnen Diagrammen gezeigten Daten sind etwas redundant. Wir halten es jedoch für sinnvoll, den Variationskoeffizienten in einem separaten Diagramm darzustellen. Die Ergebnisse zeigen deutlich, dass die Mahlgradgröße und der Probenumfang die Genauigkeit der Analyse beeinflussen. Die Studie deutet darauf hin, dass AFLA und ZON ein höheres Maß an Abhängigkeit (d.h. einen höheren VK) von Probenvolumen und Mahlgrad aufweisen als FUM, obwohl wir zögern, aus diesen einzelnen Studien eine eindeutige Schlussfolgerung zu ziehen; es sind weitere Untersuchungen erforderlich, um unsere Beobachtung zu bestätigen. Bei Probengrößen von 1 g und 5 g waren die RSDs für AFLA, FUM und ZON höher als bei Probengrößen von 10 g und 25 g. Die beobachtete Variabilität für eine 10 g Probe von mit AFLA kontaminiertem Mais sank von 58,9% (grob gemahlen) auf 9,3% (fein gemahlen), für FUM von 39,8% (grob gemahlen) auf 4,6% (fein gemahlen) und für ZON von 21% (grob gemahlen) auf 2% (fein gemahlen). Diese Ergebnisse bestätigen die Auswirkungen des Mahlgrads auf die analytische Varianz und Genauigkeit bei der Extraktion und Analyse von Mykotoxinen aus Getreide.
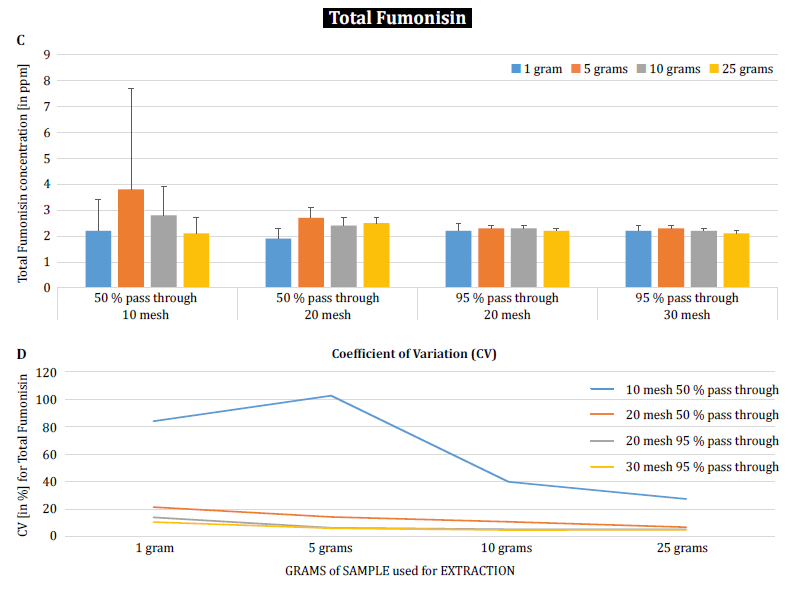
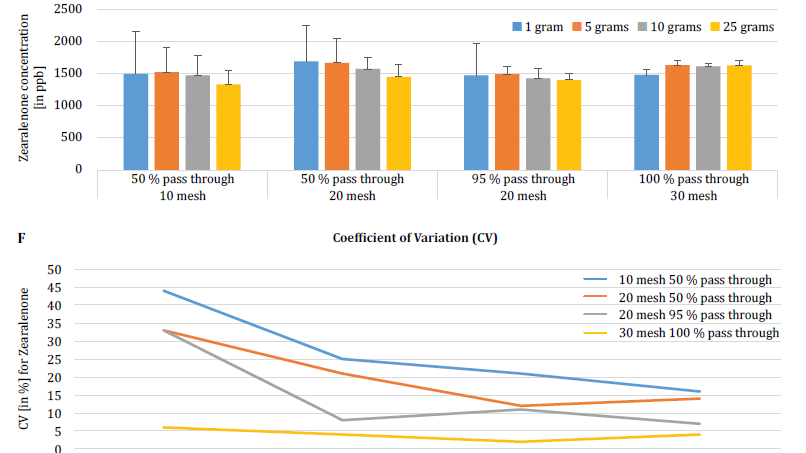
Schließlich untersuchten Brunkhorst et al. ihre Ergebnisse weiter und bestimmten den Deoxynivalenol-Gehalt in natürlich kontaminierten Gerstenproben mit demselben Untersuchungsschema. Gerstenproben wurden auf vier verschiedene Maschenweiten gemahlen, extrahiert (10 Einzelextrakte pro Maschenweite und Probengröße) mit Acetonitril/Wasser (84/16) und mittels LC-MS-MS analysiert (Abbildung 5) [6]. Die Ergebnisse zeigen deutlich, dass die analytische Variabilität verringert werden kann, wenn die Proben so gemahlen werden, dass sie durch eine feinere Maschenweite gehen. Darüber hinaus trägt eine Vergrößerung der Probengröße zu einer weiteren Verringerung der analytischen Variabilität bei. Der Variationskoeffizient konnte von 11% auf nur 5% gesenkt werden, wenn eine 10 g Probe mit einer Nr. 10 mesh. Eine Probengröße von 10 g und 25 g in Kombination mit einer Maschenweite von 20 (95%) und 30 (95%) 30 Maschen (95%) liefert genaue und präzise Ergebnisse und reduziert den CV auf 5% bzw. 3%. Da in dieser Studie Gerste anstelle von Mais verwendet wurde, deutet dies darauf hin, dass die Auswirkung der Probengröße und des Mahlens auf die analytische Variabilität der Mykotoxine möglicherweise nicht matrixabhängig ist. Weitere Studien sind notwendig, um dies zu bestätigen [6].
Schlussfolgerung: Mahlen, mischen, wiederholen nach Bedarf
Die Bedeutung der Probenvermahlung und der Probengröße sowie die Auswirkungen dieser Faktoren auf die Verringerung der Variabilität und die Minimierung von Fehlern bei der Mykotoxinanalyse sind offensichtlich. In den vorgestellten Studien wurden erhebliche Unterschiede zwischen grob und fein gemahlenen Proben derselben Quelle und desselben Kontaminationsgrads festgestellt. Über die bloße Beobachtung der Unterschiede hinaus legen die Daten aus diesen Studien einige erste Ansätze für die Probengröße und das Mahlen nahe. Was die Probengröße anbelangt, so haben sich 10 g als ausreichend erwiesen, während 25 g möglicherweise eine noch größere Genauigkeit bieten. Bei Verwendung einer 20er Masche sollten 95% der Probe durchfallen. Bei Verwendung einer Nr. 30 mesh sollten 100% der Probe durchgehen. Das Hauptziel der Mykotoxinanalyse ist es, trotz der Schwierigkeiten bei der Probenahme und der komplexen Probenvorbereitung für Getreide und Feldfrüchte genaue und zuverlässige Ergebnisse zu erhalten. Doch selbst die beste Technologie, sei es in Form von hochmodernen Schnelltests oder hochpräzisen Massenspektrometriegeräten, nützt nichts, wenn Ihre Probe nicht repräsentativ für die untersuchte Partie ist. Zu einer repräsentativen Probe gehört mehr als nur die Probenahme; die Probenvorbereitung ist der Schlüssel. Wenn Sie sich an die drei Schlüsselfaktoren der Probenvorbereitung halten (Mahlgrad, Probengröße und Homogenität), können Sie Ihre RSD bei <10% halten und so die Vertrauenswürdigkeit Ihres Analyseergebnisses erhöhen.