Los 7 pecados de las pruebas con OMG

El uso de cultivos modificados genéticamente (MG) está aumentando en todo el mundo. Esto presenta muchas oportunidades para la industria agrícola al tiempo que conlleva muchos retos para la industria del análisis. Un experto de Romer Labs comparte sus conocimientos sobre el análisis de cultivos modificados genéticamente para que pueda evitar cometer errores comunes en su laboratorio.
1. Identificar el objetivo equivocado
Haga sus deberes: éste es quizá el hábito más básico que cualquier científico puede aprender. Es especialmente necesario para las pruebas de organismos modificados genéticamente (OMG), en las que hacer los deberes significa saber qué eventos componen sus objetivos para poder evitar falsos positivos y resultados erróneos. El problema está relacionado con los rasgos. Un rasgo es una proteína derivada de una modificación genética que confiere una característica especial a la planta. Las modificaciones genéticas pueden estar presentes en diferentes combinaciones que producen rasgos similares o completamente diferentes. Entre los elementos más populares de las modificaciones genéticas se encuentran los promotores (p35S, FMV), los terminadores (NOSt), los genes que codifican ciertos rasgos útiles (cp4 epsps, pat, bar, Cry1A y otros) y los genes que codifican marcadores selectivos (NPTII, PMI). Sus técnicos deben tener en cuenta muchos factores diferentes a la hora de definir el objetivo de cualquier análisis de OMG. Asegúrese de tener en cuenta el territorio del que procede el producto, así como los posibles eventos, si estos eventos están autorizados en la región en cuestión y si la planta de interés tiene rasgos biotecnológicos disponibles comercialmente. Puede ser complicado: a veces la modificación existe pero no está autorizada o no se planta en determinadas regiones. Sin embargo, puede ser ampliamente utilizada en otra región. Además, ha habido casos de eventos no aprobados que han escapado de la contención y han llegado al campo.
2. Elegir un método defectuoso o insuficiente
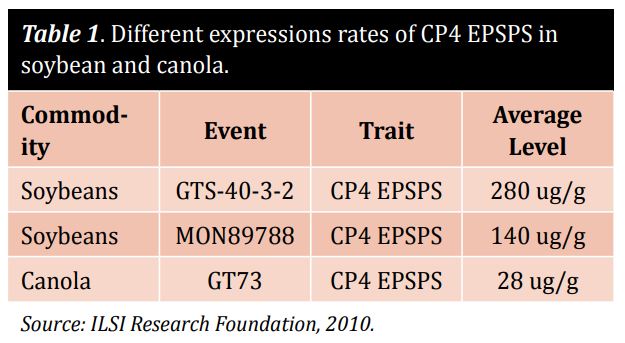
Puede ser una decisión arriesgada: ¿cuál debe ser el alcance de cualquier cribado de OMG? Los laboratorios pueden limitarse a unos pocos elementos genéticos o proteínas, o pueden ampliar el alcance a varios eventos o proteínas, lo que puede resultar caro. Es esencial encontrar el método que se adapte a sus necesidades y garantice resultados precisos. Los métodos basados en el ADN requieren mucho tiempo y dependen de una extracción de ADN de alta calidad y de controles adecuados. La variación del número de copias y la poliploidía también pueden causar problemas en las muestras y deben tenerse en cuenta a la hora de realizar análisis de ADN. Un vistazo a algunas plantas comunes ilustrará este punto. En el caso de la soja, no basta con analizar sólo los promotores y los terminadores, porque sólo unos pocos de los 15 posibles eventos de soja contienen estos elementos genéticos comunes. El maíz es una historia completamente diferente: un cribado amplio en busca de estos elementos es casi completamente suficiente, porque la mayoría de los eventos en maíz contienen estos elementos. Mientras que los métodos basados en el ADN son caros y sólo se utilizan en laboratorios de servicios analíticos, la identificación de proteínas es relativamente barata y resulta útil para detectar rasgos comunes in situ. La mayoría de los eventos transgénicos tienen su propio nivel de expresión de proteínas modificadas. Tenga cuidado al realizar el análisis proteínico de la soja y la colza con las mismas tiras del dispositivo de flujo lateral (LFD). La tabla 1 destaca los diferentes índices de expresión de CP4 EPSPS, lo que hace necesario utilizar diferentes métodos de detección LFD en la soja y la colza. El enfoque correcto utiliza diferentes pruebas y ajusta la sensibilidad para los diferentes productos básicos con el fin de alcanzar un nivel de detección similar.
3. No comprender plenamente los diferentes grados de sensibilidad de las pruebas
Los métodos basados en el ADN son muy sensibles y son capaces de detectar una sola copia del gen diana. La sensibilidad de los métodos basados en el ADN está limitada por el número de semillas analizadas. Suele ser del 0,01% o de una semilla modificada genéticamente (MG) en un conjunto de 10.000 semillas no MG. Dicha sensibilidad es más que suficiente para estar seguro en un 99,9% de cualquier nivel específico de detección hasta el 0,1%. Por otro lado, los métodos basados en proteínas tienen un límite de detección (LOD) tan bajo como el 0,1%, o 1 semilla MG en 1.000 semillas no MG. Sin embargo, esta sensibilidad no es suficiente para garantizar un resultado con un 99% de certeza. Lo mejor que se puede obtener con una prueba de una sola proteína con un LOD del 0,1% es un nivel del 0,46% con una confianza del 99%. La distribución no uniforme de las semillas en las muestras reales provoca esta discrepancia. Para estar seguro al 99% de que el nivel de contaminación por OMG es inferior al 0,1%, le recomendamos que realice al menos cuatro pruebas de 1.000 granos con una sensibilidad del 0,1% cada una. Para un 95% de confianza al 0,1%, realice tres pruebas de 1.000 granos todas con resultados negativos.
4. Eliminación de impurezas o tratamiento de la muestra
Los laboratorios de cereales suelen eliminar las impurezas de las muestras antes de realizar una prueba. Sin embargo, la purificación de las muestras de OMG no está permitida. Si quedan en las muestras algunos residuos que contengan trazas de plantas OMG, deberán ser detectados. Por ejemplo, si una muestra de maíz contiene algunos residuos de soja OMG (granos, cáscaras, polvo), el lavado y la limpieza manual eliminarán estos residuos y producirán un resultado incorrecto. No someta las muestras a ningún tipo de tratamiento térmico, ni siquiera para secar el exceso de humedad. Para los métodos basados en proteínas en particular, esto podría provocar la desnaturalización de las proteínas trazadoras y conducir a la pérdida completa de la sensibilidad de la prueba, ya que la proteína diana habría cambiado. Los anticuerpos utilizados en estas aplicaciones dejarían entonces de ser capaces de reconocer sus dianas.
5. Utilizar un procedimiento inadecuado para preparar la muestra
Su método de aislamiento del ADN debe diseñarse y seguirse cuidadosamente para evitar la degradación del ADN, que podría sesgar sus resultados. Por lo tanto, es importante verificar la calidad y la cantidad del ADN purificado. Además de los reactivos de extracción de ADN utilizados, el método de trituración también es muy importante. Los molinos de cuchillas dan los mejores resultados, ya que muelen lo suficientemente fino como para permitir la extracción del ADN. Sin embargo, es imperativo limpiar a fondo cualquier equipo de molienda después de su uso, ya que la contaminación cruzada es un gran problema en las pruebas de OMG. Un equipo que no se limpie adecuadamente podría producir resultados falsos negativos en lotes posteriores. La extracción de proteínas requiere una molienda más gruesa. Basta con triturar todas las semillas de la muestra. Si muele las semillas demasiado finas, el extracto tardará demasiado en sedimentarse y la muestra contendrá demasiadas partículas sólidas, que se pegarán a los LFD e impedirán el flujo del líquido. Los molinos utilizados para la extracción antes del análisis de los LFD deben ajustarse para evitar que se produzcan fracciones demasiado finas. También debe tenerse en cuenta la forma del recipiente de extracción: no debe ser plano, y es mejor utilizar recipientes desechables para evitar la contaminación cruzada. Las licuadoras se utilizan muy a menudo para moler para el análisis de proteínas porque son muy fáciles de limpiar, evitando así problemas de contaminación cruzada.
6. Personalizar los procedimientos de prueba o no leer el prospecto
Éste bien podría ser el pecado más grave que cometen los operadores. Mientras que los laboratorios de pruebas de referencia emplean a personal formado durante todo el año, los laboratorios de cereales suelen tener una política de empleo estacional y, por lo tanto, emplean a personal con menos experiencia en pruebas. Esto puede llevar a que el procedimiento de prueba se lea mal, se siga incorrectamente o se altere en el laboratorio. Esto puede afectar a todas las partes del proceso de prueba, empezando por la extracción y afectando a elementos de la prueba como los volúmenes de líquido necesarios para la prueba, los tiempos de desarrollo y los procedimientos de análisis. Asegúrese de leer detenidamente todos los envases y la documentación antes de realizar cualquier análisis para garantizar unos resultados fiables.
7. Limpiar insuficientemente su equipo (causando contaminación cruzada)
Asegúrese de que el molino que utiliza para el análisis de OMG es fácil de limpiar. Lo mejor es utilizar jarras y cuchillas desmontables para poder limpiarlas por separado del motor del molino. Todos los componentes de su equipo deben ser lavables. Las batidoras se utilizan habitualmente para moler muestras de OMG, ya que son fáciles de limpiar. Los molinos deben desmontarse y todas las piezas deben lavarse por separado. Lave todo el equipo con jabón líquido y aclárelo después con agua. No utilice etanol como agente de limpieza; su único uso es acelerar el proceso de secado. Cada laboratorio debe validar su procedimiento de limpieza para garantizar su eficacia. Recomendamos el uso de guantes para manipular todas las muestras. Cambiarse los guantes y lavarse las manos entre muestra y muestra también ayudará a evitar la contaminación cruzada. Asegúrese de limpiar cualquier herramienta que pueda haber entrado en contacto con el extracto de material triturado. Otra solución es utilizar material desechable en la medida de lo posible.
Publicado en:
OMG
Este artículo fue publicado en Spot On #6
¿Tiene curiosidad por ver qué le ofrece Spot On?
Lee ahora