Más allá de las pruebas inmunológicas de alérgenos

La mayoría de los kits disponibles en el mercado para las pruebas de alérgenos alimentarios se basan en la aplicación de métodos inmunológicos como ELISA o dispositivos de flujo lateral (pruebas en tira). Para llevar a cabo la prueba ELISA se requiere personal formado, pero pueden analizarse numerosas muestras en paralelo utilizando placas de microtitulación de 48 o 96 pocillos. En general, el análisis puede durar entre 30 minutos y unas horas. En la actualidad, ELISA es el método más ampliamente aplicado para la detección y cuantificación de alérgenos alimentarios. Sin embargo, aunque pueden analizarse muchas muestras al mismo tiempo, éstas sólo pueden analizarse para un analito.
Limitaciones a tener en cuenta
Debido a la elevada especificidad de los anticuerpos hacia una sola proteína alergénica concreta y a las limitaciones relacionadas con la tecnología, debe utilizarse un kit distinto para cada alérgeno. Además, el alto grado de especificidad hacia un alérgeno podría dar lugar a resultados falsos negativos. Los pasos del procesado de alimentos como el tratamiento térmico, la adición de compuestos ácidos o la fermentación pueden modificar la estructura de la proteína diana. Estos alérgenos modificados pueden perder sus propiedades inmunológicas y el complejo anticuerpo-proteína diana ya no puede formarse. Esto conduce a resultados falsos negativos o a cuantificaciones reducidas. Las pruebas en tira son baratas, muy fáciles de usar, no requieren equipo de laboratorio y dan resultados normalmente en unos minutos. Sin embargo, la mayoría de las pruebas en tira son sólo cualitativas y se basan en anticuerpos como elementos de reconocimiento. Por lo tanto, adolecen de los mismos problemas que las pruebas ELISA con alimentos altamente procesados. En los últimos años, se han establecido métodos de análisis alternativos para superar al menos algunas de las restricciones de los sistemas de pruebas inmunológicas.
Detección de alérgenos con ADN
La PCR (reacción en cadena de la polimerasa) es un método relativamente rápido y barato para identificar el ADN. Esta tecnología, desarrollada en la década de 1980, ha mejorado continuamente desde entonces. La PCR se ha utilizado durante muchos años en los campos del diagnóstico médico, la medicina forense, la vigilancia medioambiental y la cuantificación de organismos modificados genéticamente en alimentos y piensos. A principios de la década de 2000, la PCR se aplicó por primera vez para identificar el ADN de alérgenos alimentarios comunes como la avellana y el cacahuete. Hasta ahora se han publicado ensayos de PCR para la mayoría de los "ocho grandes" de EE.UU. y los 14 alérgenos alimentarios de la UE. La PCR amplifica pequeños fragmentos de un ADN diana hasta obtener un número suficiente de copias para su visualización o cuantificación. Al multiplicar la diana analítica por un factor de 107 a 109, las pocas moléculas de ADN alergénico obtenidas pueden ser suficientes para detectar con éxito los ingredientes alergénicos. Desarrollada inicialmente como un método cualitativo, la PCR se modificó posteriormente para convertirse en una herramienta de análisis cuantitativo mediante la aplicación de diferentes tintes o sondas generadoras de fluorescencia. El hecho de que la PCR detecte la molécula de ADN, extremadamente estable, podría ser una ventaja a la hora de analizar alimentos altamente procesados. El ADN tiende a no verse afectado ni siquiera por condiciones extremas y, por tanto, puede seguir detectándose incluso cuando la mayoría de las proteínas ya han sido degradadas o modificadas de algún modo. Además, la PCR puede utilizarse para alérgenos como el apio, que no pueden detectarse mediante anticuerpos. El apio tiene que estar etiquetado en la UE pero, hasta ahora, todos los intentos de producir anticuerpos fiables han fracasado debido a la estrecha relación entre el apio y otras plantas como el perejil, la zanahoria, el cilantro o el hinojo. En la última década, se han desarrollado nuevas técnicas de detección del ADN. Todos estos métodos denominados de amplificación isotérmica están relacionados de algún modo con la PCR convencional, pero pueden realizarse casi sin instrumentación. Se utiliza un simple bloque de calentamiento para amplificar el ADN diana y la posterior detección visual se realiza mediante tintes fluorescentes. La amplificación isotérmica suele ser más rápida que la PCR y menos propensa a cualquier impureza coaislada y, en muchos casos, incluso más sensible.
Publicado en:
Alérgenos alimentarios
Este artículo fue publicado en Spot On #2
¿Tiene curiosidad por ver qué le ofrece Spot On?
Lee ahora
Por qué pueden fallar las técnicas de ADN
Aunque la detección del ADN de los compuestos alimentarios alergénicos podría tener algunas ventajas sobre los métodos basados en la inmunología, este enfoque adolece de algunos graves inconvenientes. Como el ADN es el analito elegido para la PCR, es difícil/imposible discriminar entre el huevo o la leche y el ADN del tejido correspondiente de pollo o vaca, ya que comparten un ADN idéntico. Algunas muestras como la clara de huevo o la leche sólo contienen pequeñas cantidades de ADN pero muchas proteínas alergénicas y, por lo tanto, este método no es adecuado para analizar ese tipo de muestras.
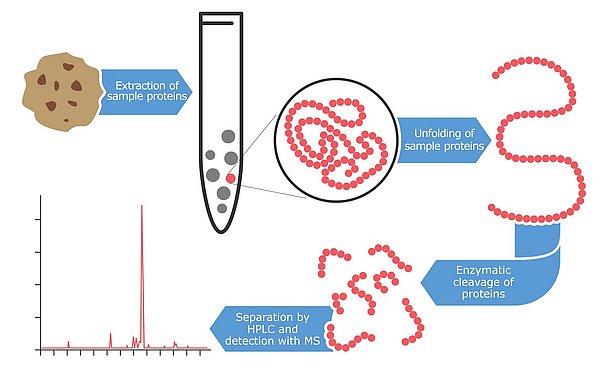
Espectrometría de masas: una tecnología de alta gama
Una tecnología aún más reciente para detectar y cuantificar alérgenos es la espectrometría de masas, un método de alta tecnología que identifica proteínas y péptidos con un nivel de precisión muy elevado. Los primeros intentos de aplicar esta tecnología a la detección de alérgenos comenzaron a finales de la década de 1990, pero la mayoría de los resultados no se publicaron hasta los últimos años. La principal ventaja de utilizar esta tecnología para las pruebas de alérgenos es el alto nivel de confianza y fiabilidad. Los instrumentos tienen la capacidad de detectar múltiples péptidos por proteína. Lo ideal es analizar de dos a tres péptidos fragmentados por alérgeno. La ventaja de este enfoque es que incluso si las proteínas están parcialmente degradadas o modificadas debido a las duras condiciones de procesado de los alimentos, la probabilidad de encontrar al menos un fragmento intacto es bastante alta. Estos péptidos marcadores se seleccionan de bases de datos o de la literatura y deben ser altamente específicos para los alérgenos que se van a cuantificar. Además, se eligen para que sean resistentes a las alteraciones del procesado de los alimentos. Esta estrategia de reconocimiento multipéptido del alérgeno no es posible con los ensayos basados en inmuno. Los anticuerpos suelen unirse sólo a un fragmento concreto (inmunogénico) del alérgeno. Si este pequeño fragmento se modifica, el reconocimiento de la diana puede verse obstaculizado. Además, la espectrometría de masas es capaz de medir varios alérgenos en paralelo. Estos métodos multianalito se han hecho especialmente populares en los últimos años. Esta estrategia innovadora permite analizar una sola extracción de una muestra para detectar numerosos alérgenos en un solo análisis. El procedimiento de extracción para el análisis por espectrometría de masas es más laborioso que para otros enfoques. En primer lugar, la muestra se mezcla con un tampón de extracción que suele contener ditiotreitol o urea para crear un entorno reductor que rompa los enlaces disulfuro de las proteínas. A continuación, el residuo de muestra restante se elimina por centrifugación y las proteínas linealizadas se escinden con enzimas de digestión. Se necesitan algunas horas o toda una noche para cortar las proteínas alergénicas con estas enzimas en pequeños fragmentos peptídicos. Aunque los pasos preparatorios requieren mucho tiempo, la solución peptídica resultante puede analizarse después en busca de varios alérgenos en paralelo utilizando el espectrómetro de masas. Los multimétodos actuales pueden cuantificar hasta siete alérgenos en paralelo, pero cabe esperar que este número aumente drásticamente en los próximos años. Los métodos multianalitos de micotoxinas empezaron con unos pocos analitos hace sólo unos 10 años y, hoy en día, los diseños de ensayo más avanzados son capaces de analizar más de 400 toxinas en paralelo.
¿El mejor método?
La espectrometría de masas puede considerarse probablemente el método de análisis de alérgenos con mayor potencial de mejora en el futuro debido a su extraordinaria fiabilidad, sensibilidad y posibilidad de realizar análisis multialérgenos.
Sin embargo, no hay método sin inconvenientes. La espectrometría de masas necesita personal altamente cualificado y los costes de inversión iniciales son elevados debido a la costosa instrumentación. Además, el tiempo necesario para obtener resultados siempre será mucho mayor que en el caso de los métodos inmunológicos.
No existe un método único
El método perfecto, un patrón oro para la cuantificación de alérgenos, no existe. Los métodos ELISA y LFD son los preferidos para la mayoría de las aplicaciones industriales. Los resultados pueden obtenerse con relativa rapidez, los costes son de moderados a bajos y el personal puede formarse fácilmente para utilizar estas pruebas. Para algunos problemas, como el material de ensayo muy procesado o analitos específicos, la PCR puede dar mejores resultados. La espectrometría de masas se sitúa en el extremo superior de las tecnologías disponibles, pero aún está en pañales para las pruebas de alérgenos. Sin embargo, en los últimos años se ha convertido en el método de elección para muchos otros retos analíticos. Cabe esperar que esta tecnología experimente un impulso en el campo del análisis de alérgenos en un futuro próximo.